北方伟业计量集团有限公司
-
登录 |
-
官方微信 |

-
在线支付 |
- 网站地图
- 产品
- 新闻
- 课堂
北方伟业计量集团有限公司









蛋白质是食品的重要组成成分,其功能特性影响食品的品质。转谷氨酰胺酶(Transglutaminase,TGase)作为一种高效、安全的生物酶交联剂,通过催化蛋白交联、酰基转移、脱酰胺基反应,改变蛋白质微观结构,从而改善食品蛋白功能特性,提高食品营养价值,降低致敏性。本文对近年来国内外转谷酰胺酶改性食品蛋白的研究进行综述,阐述了TGase对食品蛋白不同功能特性的改变,以及其对蛋白致敏性、消化性和风味的影响,总结归纳了TGase改性与其他技术复合使用的应用结果,并指出TGase改性未来的研究方向,以期为TGase改性研究及食品加工应用提供参考。
天然蛋白存在着溶解度低、凝胶性差、起泡性弱、易致敏等缺点,采用酶法技术改变蛋白结构,改善其特性,提高食品品质,扩大销售范围。酶法改性是利用酶催化蛋白水解或蛋白交联,从而使得蛋白分子发生水解或蛋白分子间(内)发生交联,来达到改变蛋白的功能特性的目的。目前,催化蛋白交联的酶主要有以下四类:转谷氨酰胺酶(Transglutaminase,TGase)、酚氧化酶、过氧化物酶、赖氨酰氧化酶。其中,转谷氨酰胺酶研究的较为深入。如表1所示,该酶催化底物广泛,性能改善明显。
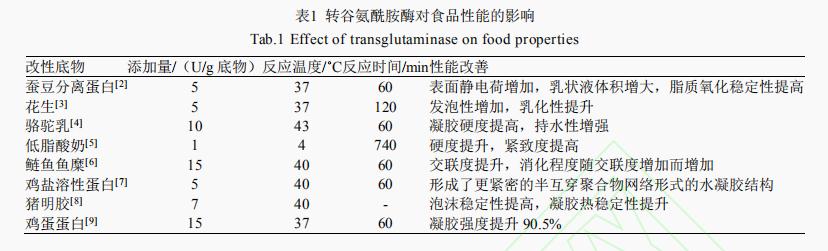
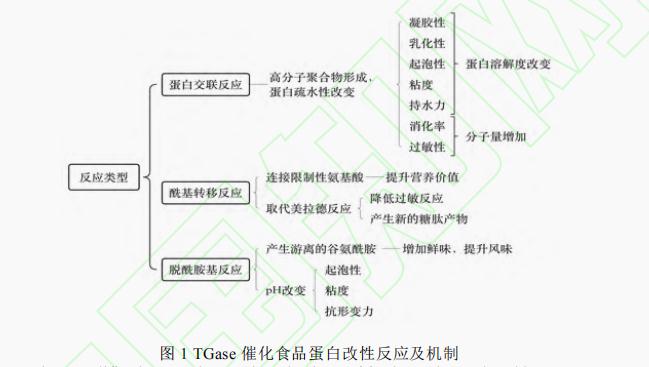
TGase根据来源不同可以将转谷氨酰胺酶分为内源性转谷氨酰胺酶及微生物来源转谷氨酰胺酶(Microbial transglutaminase,MTGase)。内源性转谷氨酰胺酶在自然界中存在广泛,但从植物或动物中提取得到的该酶产量低、提纯难且催化反应依赖Ca2+。相比于MTGase,内源性转谷氨酰胺酶催化活性位点被Cys残基和Try残基组成的氢键覆盖,只有当底物中存在Ca2+,才能发生构象变化,暴露出活性位点;而MTGase催化活性位点上的Cys64能够充分暴露在溶剂中,因此反应不需要依赖Ca2+且反应迅速。TGase在参与催化反应时,酰基供体为该酶肽链上谷氨酰残基的γ-酰基,酰基受体可以为赖氨酸上的ε-氨基、伯氨基和水。根据受体的不同,反应可分为蛋白质交联反应,酰基转移反应和脱酰胺基反应。各反应对蛋白特性的影响如图1所示。本文将从蛋白功能特性、其他特性及与新技术复合使用三个方面进行阐述。
1转谷氨酰胺酶对食品蛋白功能特性的影响
1.1凝胶性
凝胶是介于固体和液体之间的中间状态,通过共价或非共价键交联聚合物分子,形成能够截留水或其他小分子物质的三维网络结构,是食品蛋白重要功能特性之一。与传统的热致凝胶相比,TGase可催化低蛋白浓度,甚至不能成胶的蛋白溶液形成凝胶,且凝胶的凝胶强度和弹性模量远远大于相同条件下的热致凝胶。蛋白的凝胶作用可以形成独特物理状态的食物,如豆腐、酸乳、干酪等。
豆制品中,酶较易催化7S球蛋白聚合,不易使11S球蛋白聚合;且只能使蛋白中的酸性亚基聚合,几乎不能使其碱性亚基聚合。这主要是因为7S球蛋白含有相对较高含量的谷氨酰胺和赖氨酸,而谷氨酰胺和赖氨酸是TGase的主要底物。TGase交联大豆分离蛋白有助于豆腐形成更持久的凝胶,并能更长久地保存豆腐的结构特性。
在肉制品加工过程中,TGase通过交联作用,改变肌球蛋白重链结构,降低-螺旋含量,增加-折叠含量,有助于形成高分子聚合物,改善蛋白溶解度,从而改变蛋白凝胶性。在交联时,TGase的首要目标是肌球蛋白中的S1亚基。由于空间受限,肌球蛋白易被氧化。在轻度氧化条件下,TGase诱导的肌球蛋白交联区域在肌原纤维结构中由S1亚基向S2亚基转移。TGase可以在轻度氧化时促进S2交联,S2可成为新的交联区域,该发现可应用于不需被抑制氧化的肉制品加工中。在所有肉制品加工过程中,TGase只会对肌球蛋白产生作用,对肌动蛋白没有明显影响。
在乳制品中,TGase的主要作用蛋白还存有异议。有学者认为TGase对乳清蛋白的作用不明显,主要作用于-酪蛋,因为其主要位于酪蛋白胶束的表面,接近酶催化位点。酪蛋白交联后,可防止尿素及柠檬酸的分离,对酸乳发酵等有一定的指导意义。在乳制品的加工中,凝乳酶的类型、TGase的添加顺序,酶的孵育时间都会影响乳制品的品质,出成率。TGase在凝乳酶之前加入,会引起其与凝乳酶活性的竞争反应,从而使得产品品质下降。但也有学者研究发现在加入凝乳酶之前加入TGase,生产的奶酪,产量更高、质地更软。二者的矛盾可能是由凝乳酶的类型不同造成的。目前,研究乳制品多集中在中性条件,但是在酸性条件下的交联还未被深入探究。
1.2持水力
持水力通常定义为蛋白截留水及储存水的能力,即蛋白与水的相互作用。水分是大多数食品中含量最高的组分,含量及分布状态通常影响着产品的嫩度、鲜度、货架期及风味等。Fariba等研究了不同TGase水平对红罗非鱼鱼糜凝胶特性的影响,其结果表明TGase(0.30 U/g鱼糜)的交联作用提高鱼糜凝胶持水力,主要是因为形成的蛋白凝胶,网络结构致密均匀,从而截留住更多的水。TGase催化的脱酰胺反应,降低面包烘焙损失,蛋白质的亲水性增加,使得其与蛋白质重链聚合产生的强凝胶结构结合。但是在玉米中研究发现,酶的脱酰胺作用普遍存在,底物中蛋白质和赖氨酸含量有限,阻碍了交联的形成,使得玉米面包的黏度降低。
因此,MTGase催化的脱胺反应和交联的形成直接影响不同蛋白质底物的持水力。与凝胶性相似,随着酶添加量的持续增加,酶添加量与持水力呈负相关。因为蛋白间和蛋白内的交联数越多,蛋白与水的相互作用越低,蛋白截留水越困难。
1.3乳化特性
蛋白质的乳化特性影响着冰淇淋、蛋糕等食品的品质。在乳液体系中,蛋白质作为主要的表面活性剂,其较好的表面活性有助于分散相的形成和稳定。良好的表面活性剂必须具有以下特点:(1)快速进行界面吸附;(2)在界面上快速分散及重新定位;(3)在到达界面时,能与邻近分子相互作用,形成能够承受热冲击和机械冲击的、强而有粘性的粘弹性膜。
TGase的交联和脱酰胺反应都影响着蛋白的乳化特性。交联反应使猪肉肌原纤维蛋白结构发生改变,促进分子聚集到油滴表面,产生静电排斥,从而阻止聚集、絮凝和油水两相分离,提高乳液的稳定性;在研究肌原纤维蛋白-非肉蛋白-橄榄油复合乳化液时,异型肽键的生成改变了蛋白表面基团的疏水基团/亲水基团的比率,可能改变蛋白构象,增加负电荷的数量,有助于在乳液洁面形成更有弹性的蛋白膜,从而增加蛋白乳化稳定性;但有学者研究鲤鱼肌原纤维蛋白时发现,乳化性降低,交联反应破坏了蛋白与蛋白之间的热力学平衡,溶解性降低,平均粒径增加,乳化粒子减少。综上,乳化特性的改变可能与交联度相关。此外,脱酰胺反应会导致pH下降,极性基团增加,进而促进蛋白质在水面上的展开。范丽丽等发现,在酶添加量为20 U/g,pH 7.0,温度55˚C条件下,表面疏水性增强,提升了蛋白对油脂的吸附,改善了蛋白的乳化性。
声明:本文所用图片、文字来源《食品与发酵工业》版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系

伟业计量征文大赛送积分啦!只要您在8月27日--8月31日点击“我要报名”报名参赛,并于9月1日开赛当天投稿,就可获得高达5000积分奖励,快来参加吧!
了解更多> >通话对您免费,请放心接听
温馨提示:
1.手机直接输入,座机前请加区号 如13803766220,010-58103678
2.我们将根据您提供的电话号码,立即回电,请注意接听
3.因为您是被叫方,通话对您免费,请放心接听

登录后才可以评论