北方伟业计量集团有限公司
-
登录 |
-
官方微信 |

-
在线支付 |
- 网站地图
- 产品
- 新闻
- 课堂
北方伟业计量集团有限公司









目的研制一种能够用于快速鉴定单核细胞增生李斯特菌(以下简称单增李斯特菌)的质粒DNA标准物质。方法设计一种质粒DNA包含目前常用于单增李斯特菌检测的hlyA、plcB、inlA基因,并对其稳定性、均匀性和量值可追溯性进行评价。评估其在实时定量聚合酶链式反应(PCR)检测中的适用性。结果质粒DNA参考物质的最终定值结果为29.85μg/mL。该质粒DNA参考物质量值可靠,均匀性和稳定性良好,可以在-20℃下保存1年以上。质粒DNA参考品在实时荧光PCR检测中的适用性证明,可以保证实时定量PCR检测结果与单增李斯特菌基因组DNA参考品具有可比性。结论研制的质粒DNA标准物质可以替代单增李斯特菌基因组DNA对单增李斯特菌进行质量监控,满足单增李斯特菌检测在实验室质量的有效控制和试验方法验证的需要。
单核细胞增生李斯特菌(Listeria monocytogenes,以下简称单增李斯特菌),归属于李斯特菌属(Listeria),在世界范围内被公认是一种重要的人兽共患食源性致病菌,该菌具有较强的致病性,可导致单核细胞增多、败血症、脑膜炎、孕妇流产及死胎等。单增李斯特菌易通过肉乳制品引起人的感染发病,因此世界多国卫生部门已经逐步重视起对单增李斯特菌的防控。
目前单增李斯特菌的实验室检测已经从微生物学检测转向核酸检测。PCR方法原理是利用单增李斯特菌区别于李斯特菌属内其他细菌的多个靶基因选择特异性序列建立PCR以及实时荧光PCR。单增李斯特菌毒力基因主要集中在两个毒力岛IPI-1和LIP-2,其中李氏溶血素基因(hlyA)、磷脂酶C基因(plcB)属于LIP-l,内化素基因(inlA)属于LIP-2。hlyA基因编码的李斯特菌溶血素O(1isteriolysin,LLO)是单增李斯特菌最重要的一种毒力因子,是单增李斯特菌检测的关键性靶标,联合检测三种毒力基因将有助于了解李斯特菌的毒力状况,并进行相关分型。
但是作为PCR检测方法相应的核酸参考品目前十分缺乏。基因组DNA作为参考品,难以同时为多个靶标提供可溯源的定量参考。小片段核酸则无法在多种检测试剂和方法之间提供可参比的参考性。因此新型的可对多种检测靶标量值溯源的核酸参考材料对于李斯特菌的核酸检测发展至关重要。
本研究中,拟通过合成含有单增李斯特菌检测的hlyA、plcB、inlA基因的质粒作为荧光定量聚合酶链反应(qPCR)参考品,并就其均匀性、稳定性等性能进行评价,探讨其替代传统基因组参考品的可行性,以期这种可追溯的、有效的参考材料可以解决病原核酸检测能力快速发展与缺乏参考材料之间的矛盾。
单增李斯特菌标准菌株(ATCC 19115),由广州海关检验检疫中心保存。全基因人工合成等服务由上海吉玛生物工程有限公司提供;引物合成、DNA测序由华大基因科技股份有限公司提供。ABI SYBR FAST qPCR Master Mix(2×)(英国New England Biolabs)。
根据单增李斯特菌检测的hlyA(GenBank:KC770796.1)、plcB(GenBank:JF712529.1)、inlA(GenBank:EF445938.1)基因序列人工合成一段基因作为检测靶标片段。单个基因的核酸序列可在美国国立生物技术信息中心。将三个基因以1∶1的比例串联在一起(以不相关的基因片段aagtcg隔开),并克隆到pUC57中以形成重组质粒,命名为pDNA Listeria,扩增纯化后用于进一步试验。
采用紫外分光光度(UV)法对质粒DNA的纯度进行鉴定,通过检测样品在260、280、230 nm波段的紫外光下的吸光度值(A260,A280,A230),确定样品纯度,排除RNA和蛋白质污染。质粒DNA的A260/A280在1.8~2.0之间,A260/A230大于2.0被认为纯度符合参考品要求。
依照国际标准化组织(International Organization for Standardization,ISO)规定的方法进行取样,最小采样量为1μL,使用UV法分析pDNA的瓶间性和瓶内均匀性。
瓶内均匀性检测:随机选择9管pDNA,从每管样品的上层、中层和下层分别提取1μL测试用样品,UV法检测后方差分析(F-测试)瓶内均匀性。
瓶间均匀性检测:随机选择10管pDNA,并用UV法对每管中提取的1μL样品重复测量3次,方差分析瓶间均匀性。并根据ISO指南35评估pDNA均匀性的不确定性贡献。根据公式(1)计算质粒DNA的瓶间不均匀性引起的不确定度(uh):所有公式中变量均改为斜体
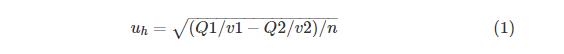
其中:Q1为组间差方和,Q2为组内差方和,v1为组间自由度,v2为组内自由度,n为组内测量次数。
在标准物质制备中需要考虑物质的长期稳定性和短期稳定性。分别选择4、-20、-70℃UV法进行短期稳定性(6个月)试验,56℃(2个月)进行极端温度试验,温度-20℃作为制备的质粒标准物质的特定储存条件进行长期稳定性试验(每月UV法检测一次,一共检测12个月)。监测质粒pDNA Listeria在储存期间的稳定性。并根据ISO指南35评估长时间保存的稳定性,并评估稳定性的不确定性贡献。进一步根据公式(2)计算质粒DNA在12个月内的长期稳定性引起的不确定度(us):

其中:β1是稳定性线性模型中的斜率,S(β1)是斜率的标准偏差,N是稳定性评估的总时间,N=12个月。
声明:本文所用图片、文字来源《中国食品卫生杂志》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系删除。

在实际工作中,可以与经典常规方法进行互补,缩短检测时间,适合现场快速检测,在进出口食品安全检测方面具有良好的应用前景。2016年开始本团队陆续开发出近红外荧光免疫层析试纸条检测食源性致病菌,检测对象包括沙门氏菌、霍乱弧菌和副溶血弧菌等。通过研究发现近红外荧光免疫检测法灵敏度较高[25,26]。采用近红外荧光免疫测定法,可以避免人为判读的错误,结果客观、准确,容易保存,为现场提供快速、准确的检测方法
了解更多> >制备一种单核细胞增生李斯特菌的特异性单链抗体捕获磁珠(scFv-IMBs),通过用人工污染的方式评价scFvIMBs的效果。在不同的增菌培养体系中以市售磁珠(Dyna-IMBs)作为对照,通过定性、定量培养技术和PCR检测技术,分析scFv-IMBs在法兰克福香肠中捕获与分离单核细胞增生李斯特菌和英诺克李斯特菌的能力。
了解更多> >制备一种单核细胞增生李斯特菌的特异性单链抗体捕获磁珠(scFv-IMBs),通过用人工污染的方式评价scFvIMBs的效果。在不同的增菌培养体系中以市售磁珠(Dyna-IMBs)作为对照,通过定性、定量培养技术和PCR检测技术,分析scFv-IMBs在法兰克福香肠中捕获与分离单核细胞增生李斯特菌和英诺克李斯特菌的能力。
了解更多> >制备一种单核细胞增生李斯特菌的特异性单链抗体捕获磁珠(scFv-IMBs),通过用人工污染的方式评价scFvIMBs的效果。在不同的增菌培养体系中以市售磁珠(Dyna-IMBs)作为对照,通过定性、定量培养技术和PCR检测技术,分析scFv-IMBs在法兰克福香肠中捕获与分离单核细胞增生李斯特菌和英诺克李斯特菌的能力。
了解更多> >通话对您免费,请放心接听
温馨提示:
1.手机直接输入,座机前请加区号 如13803766220,010-58103678
2.我们将根据您提供的电话号码,立即回电,请注意接听
3.因为您是被叫方,通话对您免费,请放心接听

登录后才可以评论